

Next: Literatur
Up: Anhang
Previous: Symmetrie
Brechen chemischer Bindungen
Die restricted Hartree-Fock (RHF) Methode erlaubt es nicht, chemische Bindungen
korrekt homolytisch zu spalten.
Betrachten wir beispielsweise den Fall des Wasserstoffmoleküls, H2
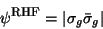 |
(132) |
Das Molekülorbital 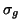 besteht (in der Näherung der Minimalbasis)
aus einer geraden Linearkombination aus, an den jeweiligen Atomkernen
zentrierten Funktionen a und b
besteht (in der Näherung der Minimalbasis)
aus einer geraden Linearkombination aus, an den jeweiligen Atomkernen
zentrierten Funktionen a und b
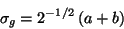 |
(133) |
Aus der Linearität der Slater-Determinante [siehe Gln. (43)] folgt
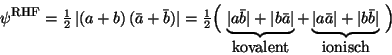 |
(134) |
und man sieht, daß neben dem (physikalisch korrekten) kovalenten Anteil
(mit gleichem Gewicht) auch ionische Anteile (d.h. H+ + H-)
vorliegen.
Es sei an dieser Stelle bemerkt, daß die Valence-Bond-Wellenfunktion
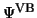
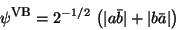 |
(135) |
von vornherein korrekt dissoziiert.
Gemäß der Gln. (134) enthält die RHF-Wellenfunktion stets einen
ionischen Bindungsanteil von 50 %, woraus folgt, daß am
HF-Basislimit Bindungslängen unter- und elektrische Multipolmomente
überschätzt werden sollten.
Dieses Problem wird durch einen MCSCF-Ansatz der Form
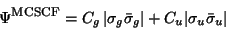 |
(136) |
mit
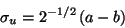 |
(137) |
gelöst, da mit diesem, die für große Abstände richtige Form
des Valence-Bond-Ansatzes (135) dargestellt werden kann.
Bei endlichen Abständen liefert die MCSCF-Wellenfunktion (136)
durch das Beimischen
ionischer Anteile eine etwas bessere Energie als die VB-Methode,
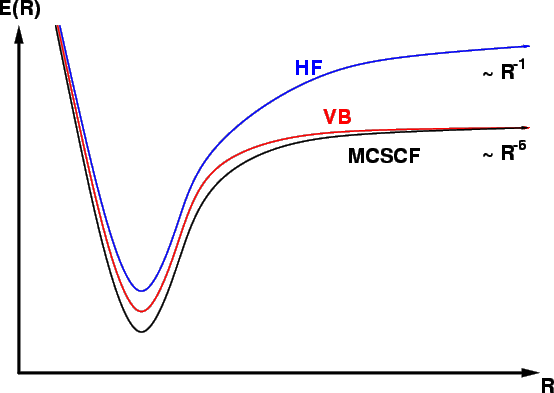
vergleiche Fig. 8.
Abbildung 8:
Brechen einer chemischen Bindung mit
MO-, VB- und MCSCF-Methoden
(schematisch)
 |


Next: Literatur
Up: Anhang
Previous: Symmetrie
Robert Gdanitz
1999-07-05
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.