Eine besonders einfache Form nimmt die LCAO-Entwicklung homonukleare zweiatomige Moleküle an; das sind Moleküle mit gleichen Atomen, wie beispielsweise H2, O2, N2 usw. Unsere Erfahrungen, mit dem einfachsten dieser Systeme, dem Wasserstoffmolekül-Ion H2+, lassen sich leicht auf andere homonuklearen Moleküle übertragen. Es kommen allerdings einige Besonderheiten hinzu, insbesondere dann, wenn mehr als ein Elektron an der Bindung beteiligt ist. Analog zu den Atomen wollen wir jedem Elektron im Molekül ein Orbital zuordnen und diese Molekülorbitale (MO) in der Reihenfolge zunehmender Energie mit Elektronen besetzen, wobei wir natürlich das Pauli-Prinzip beachten müssen. Wir stellen diese MOs in erster Näherung als Linearkombination von Atomorbitalen dar. Aus den 1s-Orbitalen der beteiligten Atome kann man zwei MOs aufbauen, so wie wir sie bereits beim H2+-Ion kennengelernt haben:
wobei wir die (unterschiedliche) Normierungskonstante übersichtlichkeitshalber weggelassen und die neuen Wellenfunktionen mit dem griechischen Buchstaben σ (in Analogie zu s bei Atomen) versehen haben. Die Bedeutung der Indices wird spaeter erörtert. Wir beachten, dass in den Säkulargleichungen die Größen αA und αB bei homonuklearen Molekülen gleich sein müssen: αA = αB = a. Dies hat auch zur Folge, dass die beiden Wellenfunktionen mit dem gleichen Gewicht (aber eventuell unterschiedlichen Vorzeichen) eingehen.
Ein ursprünglich entartetes Paar von Energiewerten α
spaltet also in zwei verschiedene Werte auf und zwar symmetrisch bzgl.
des ursprünglichen Energiewertes, falls S, das Überlappungsintegral,
klein gegen 1 ist. Der eine neue Energiewert liegt dann höher und
der andere niedriger als zuvor. Das MO mit der tieferen Energie ist das
bindende
MO, denn dessen Energie ist kleiner als die der getrennten Atome. Das
andere MO mit der höheren Energie ist das antibindende MO;
dessen Energie ist größer als die der getrennten Atome. Die
Ergebnisse sind in der Abbildung schematisch dargestellt.
| antibindendes MO
_____ / \ ________/ \______ \ / \______/ bindendes MO |
Wir besetzen nun die MOs in der energetischen Reihenfolge mit Elektronen unter Beachtung des Pauliprinzips. Für das H2 erhalten wir dann die Wellenfunktion σg(1) für das eine Elektron und σg(2) für das andere Elektron. Die Gesamtwellenfunktion ist dann in unserem MO-Bild:
Die beiden ersten Terme geben an, dass sich die beiden Elektronen an unterschiedlichen Kernen (hier Protonen) aufhalten, während die beiden letzten Terme beschreiben, dass sich beide Elektron an einem Kern (A bzw. B) aufhalten. Ein anderer Ansatz von Heitler-London lässt einfach diese beiden letzten Terme weg, da sich die Elektronen gegenseitig abstoßen und daher nicht zu erwarten ist, dass sie sich beide am gleichen Kern aufhalten (d.h. es besteht eine Korrelation zwischen den beiden Elektronen). Gelegentlich tun sie es aber doch. Daher sind MO und Heitler-Londer zwei extreme Ansätze; die bessere Beschreibung der Molekülwellenfunktion wird dazwischen liegen. Z.B. im sogenannten ionischer Ansatz:
Yges = fA(1)φB(2)+φA(2)φB(1) + c[φA(1)φA(2)+φB(1)φB(2)]
mit c als Variationskonstante.
Mögliche Kombinationen von Atomorbitalen vom s-Typ, p-Typ und d-Typ
sind in der folgenden Tabelle aufgeführt:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Die Kombination von atomaren p-Orbitalen zu MOs ist in der nächsten Abbildung dargestellt (diverse MOs zum Anklicken: 1s+1s, 2s+2s, 2pz-2pz, 2pz+2pz, 2px+2px, 2px-2px). Die Negativkombination zweier pz-Orbitale (der Konvetion entsprechend entspricht die z-Richtung der Kernverbindungsachse) führt zum bindenden Zustand σg, während die positive Linearkombination dieser pz-Orbitale zum antibindenden σu führt. Sowohl die Kombination von px-als auch von py-Orbitalen ergibt π-Orbitale, die daher zweifach entartet sind. Die positive Linearkombination führt zu einer großen Überlappung und ergibt daher ein bindendes MO (πu), während die negative Kombination zum antibindenden MO (πg) führt.
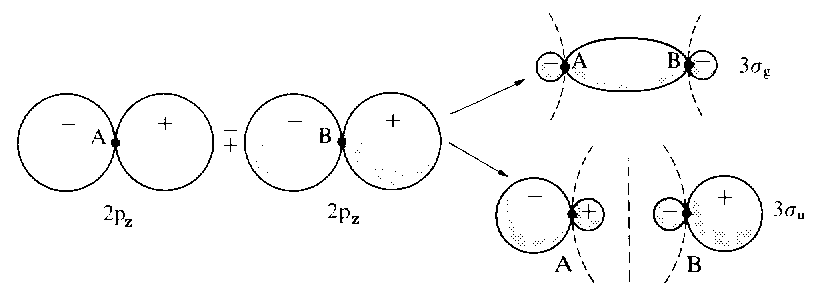 |
| Die Kombinationen von zwei 2pz-Atomorbitalen zur Erzeugung eines bindenden und eines antibinden Molekül- orbitals, symbolisiert durch 3σg und 3σu. Die z-Achse zeigt nach rechts; man beachte die Vorzeichen an den Lappen und wie diese kombinieren (die Negativkombination führt zum bindenden Zustand). Die Knotenflächen sind durch unterbrochenen Linien angedeutet. |
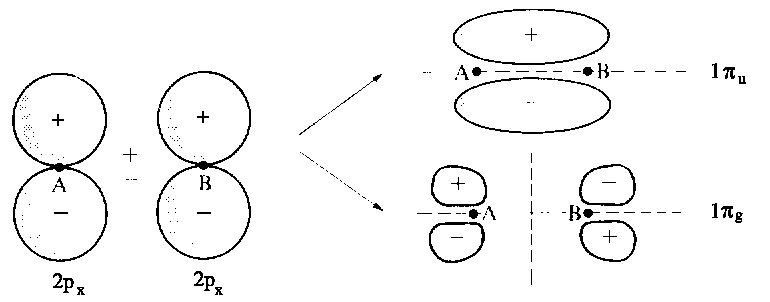 |
| Die Kombination von zwei 2px-Atomorbitalen zur Erzeugung eines bindenden und eines antibindenden Molekül- orbitals, symbolisiert durch 1πu und 1πg. Die x-Achse verläuft senkrecht zur Bindungsachse. Man beachte die Vorzeichen an den Lappen. Im Gegensatz zur Kombination zweier pz-Atomorbitalen führt eine positive Kombination zum bindenden Zustand. Die Knotenfläche sind durch unterbrochene Linien angedeutet. πu und πg sind jeweils zweifach entartet, da das andere MO entsprechend mit den 2py-AO konstruiert wird. |
Die Symbole, die man zur Kennzeichnung der Molekülorbitale verwendet, besitzen eine gewisse Ähnlichkeit mit denjenigen für Atomorbitale. Die Symbole s, p, d,...bei den Atomen stehen im Zusammenhang mit σ, π, δ und beziehen sich auf den Drehimpuls der Elektronen bezgl. der Kernverbindungsachse und auf die Symmetrie des Molekülorbitals:
Die Zahlen 1, 2, 3, ... die vor dem Symmetriesymbol stehen, zählen die Molekülorbitale einer bestimmten Symmetrie in energetisch aufsteigender Reihenfolge.
Wollen wir wie im Fall der Atome auch für die Molekülstruktur
ein Aufbauprinzip einführen, so müssen wir die energetische
Reihenfolge der Molekül-Orbitale kennen. Nach heutigen Erkenntnissen
lautet diese Reihenfolge
|
|
Bei zweiatomigen Molekülen mit Atomen aus der zweiten Reihe des Periodensystems liegt σg immer unterhalb von πu. Es ist zu beachten, dass jedes π-MO zweifach entartet ist, denn wir können z.B. unter dem 1πu-MO das Paar 1πxu und 1πyu verstehen, das den Aufbau aus px- und py-AO deutlich macht.
Nun ist es relativ einfach, mit Hilfe des Aufbauprinzips zweiatomige Moleküle mit gleichen Kernen zu beschreiben (s. Tabelle). Die MOs besetzen wir im Sinne des Pauli-Prinzips mit Elektronen, wobei zu beachten ist, dass ein π-Niveau aufgrund der Entartung maximal 4 Elektronen aufnehmen kann. Wir haben bereits gesehen, dass H2 die beiden Elektronen das bindende MO besetzten, so dass die Elektronenkonfiguration (1σg)2 lautet. Gehen wir weiter zum He2+, so hat dieses die Grundzustandskonfiguration (1σg)2(1σu); He2 hätte die Konfiguration (1σg)2(1σu)2. Tatsächlich ist He2 im Grundzustand ein instabiles Molekül, während es in spektroskopisch beobachteten angeregten Zuständen, in denen ein Elektron sich in einem energetisch höher liegenden MO befindet, stabil ist (z.B. (1σg)2(1σu)(2σg)).
Die Instabilität von He2 illustriert ein ziemlich allgemeines Prinzip: Sind ein bindendes MO und sein entsprechender antibindender "Partner" beide voll besetzt, so gibt es keine resultierende Bindung, ja sogar eine leicht überwiegende Antibindung (Abstoßung), da die Energieaufspaltung nicht völlig symmetrisch ist. Unter "Partnern" verstehen wir zwei Molekülorbitale, die aus demselben AO-Paar aufgebaut sind.
Für die inneren Schalen (mit sehr kleinen Werten für s) ist die MO-Beschreibung identisch mit der für die ungestörten Atome. Im allgemeinen werden die inneren Schalen durch die Buchstaben K, L, M, ... bezeichnet, so dass Li2 mit zwei Valenzelektronen außerhalb der inneren Schalen entweder als
geschrieben werden kann, wobei KK die beiden ungestörten K-Schalen sind. Auf ähnliche Weise erhalten wir die Konfiguration für F2
wobei (1πu)4 das entartete Paar der doppelt besetzten Molekülorbitalen (1πxu)2(1πyu)2 ist. Nun sind 2σg und 2σu bindende und antibindende Partner und ebenso 1πu und 1πg. Daraus folgt, dass von den 14 Valenzelektronen nur das (3σg)2-Paar zur Bindung beiträgt; somit ist die Einfachbindung vom σ-Typ erklärt.
Die Gesamtkonfiguration der Elektronen (Termsymbole) setzt sich aus den einzelnen Elektronenkonfigurationen zusammen. Details und eine Zusammenfassung der Notation gibt es durch Anklicken. Die Termsymbole werden durch große griechischen Buchstaben Σ, Π, Δ, ....(Projektion des Gesamtdrehimpulses auf die Kernverbindungsachse), einem tiefgestellen Index g oder u (bei Molekülen mit Symmetriezentrum) und einem vorgestellten hohen Index, der die Spinmultiplizität 2S+1 für den Gesamtspin S wiedergibt, gekennzeichnet. Der Vorzeichenindex ± bei Σ-Zuständen bezieht sich auf das Verhalten der Wellenfunktion bezüglich einer Spiegelung an einer beliebigen Ebene, die die Kerne enthält.
Beispiele:
2Πu Gesamtspin
= 1/2; Gesamtdrehimpuls = 1; Wellenfkt. wechselt Vorzeichen bei Spiegelung
am Symmetriezentrum.
3Σg-
Gesamtspin = 1 ; Gesamtdrehimpuls = 0; Vorzeichen derWellenfkt. bei Spiegelung
am Symmetriezentrum bleibt erhalten
| Elektronenkonfiguration für die Grundzustände der homonuklearen zweiatomigen Moleküle | ||||||
| Elektronenkonfiguration* | Anzahl der
Valenzelektronen bind. - antibind.
|
Bindungen |
Bindungs-
energie /eV |
Termsymbol | ||
| H2+ | 1σg | 1 | 0 | ½ | 2,793 | 2Σg+ |
| H2 | 1σg2 | 2 | 0 | 1 | 4,748 | 1Σg+ |
| He2+ | 1σg2 1σu | 2 | 1 | ½ | 2,470 | 2Σu+ |
| He2 | 1σg2 1σu2 (=KK) | 2 | 2 | 0 | 0,001 | 1Σg+ |
| Li2+ | KK 2σg | 1 | 0 | ½ | 1,46 | 2Σg+ |
| Li2 | KK 2σg2 | 2 | 0 | 1 | 1,068 | 1Σg+ |
| Be2 | KK 2σg2 2σu2 | 2 | 2 | 0 | 0,096# | 1Σg |
| B2 | KK 2σg2 2σu2 1πu2 | 4 | 2 | 1 | 3,08 | 3Σg− |
| C2+ | KK 2σg2 2σu2 1πu3 | 5 | 2 | 1½ | 5,40 | 2Πu |
| C2 | KK 2σg2 2σu2 1πu4 | 6 | 2 | 2 | 6,32 | 1Σg+ |
| N2+ | KK 2σg2 2σu2 3σg 1πu4 | 7 | 2 | 2½ | 6,478 | 2Σg+ |
| N2 | KK 2σg2 2σu2 3σg2 1πu4 | 8 | 2 | 3 | 7,519 | 1Σg+ |
| O2+ | KK 2σg2 2σu2 3σg2 1πu4 1πg | 8 | 3 | 2½ | 6,781 | 2Πg |
| O2 | KK 2σg2 2σu2 3σg2 1πu4 1πg2 | 8 | 4 | 2 | 5,214 | 3Σg− |
| F2+ | KK 2σg2 2σu2 3σg2 1πu4 1πg3 | 8 | 5 | 1½ | 3,405 | 2Πg |
| F2 | KK 2σg2 2σu2 3σg2 1πu4 1πg4 | 8 | 6 | 1 | 1,659 | 1Σg+ |
| * Diese Reihenfolge der
Orbitale ist nicht in allen Fällen die energetische Sequenz.
# berechnet von R.Gdanitz (Dez. 1998). |
||||||
Erstens: Die Begriffe Einfach-, Zweifach-, Dreifachbindung beziehen sich auf die Anzahl der bindenden Elektronenpaare, die effektiv zur Bindung beitragen. Die Bindungsart hängt vom σ- oder π-Typ des Paares ab. Die charakteristischen Elektronenkonfigurationen lauten
Einfachbindung σ2, Doppelbindung σ2π2, Dreifachbindung σ2π4.
Für die Atome der ersten Reihe gibt es keine weiteren Bindungsarten, aber für Moleküle mit schweren Atomen gibt es auch noch andere Möglichkeiten. In einigen starken homonuklearen Metall-Metall-Bindungen kann es auch Vierfachbindungen mit der Konfiguration σ2π4δ2 geben.
Zweitens: Das Prinzip der maximalen Überlappung besagt, dass π-Atomorbitale (senkrecht zur Bindung weniger überlappen als σ-Atomorbitale (parallel zur Bindung) und dass deshalb π-Bindungen schwächer als σ-Bindungen sind. Entsprechend sind antibindende σ-Orbitale stärker abstoßend als π-Orbitale.
Drittens: Beim Besetzten entarteter Orbitale (in diesem Fall ist es das πx, πy,-Paar) ist die Hundsche Regel wie beim Aufbauprinzip der Atome zu beachten. So sind beim O2-Molekül alle Niveaus bis zu 1πu hinauf voll besetzt und der parallele Spin in den entarteten 1πg-Niveaus führt zu einem Triplett-Grundzustand (S = 1).
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.