Symmetrien und Erhaltungssätze:
Symmetrien und Eigenschaften:
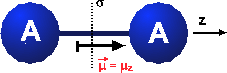
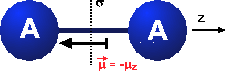
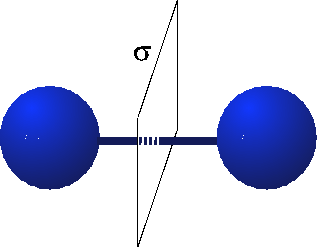
Symmetrien in der Chemie
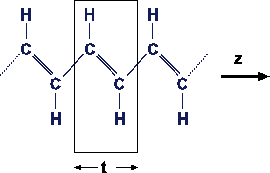
(c) Polyacetylen
Fazit über Symmetrien
Symmetrien bedingen Vereinfachungen, was auch eine einfacherer
mathematische Beschreibung zur Folge hat.
Und hier feiert die Gruppentheorie ihre großen chemischen Erfolge:
Unter dem Gesichtspunkt, dass viele chemische und physikalische Eigenschaften eines Atoms, Ions, Moleküls oder Kristalls maßgeblich von deren Symmetrie beeinflußt werden, gewinnt die Einbeziehung von Symmetriebetrachtungen für das Verständnis der Eigenschaften und dem Verhalten chemischer Verbindungen zunehmend an Bedeutung.
So kann z. B. der piezoelektrische Effekt bei Quarzkristallen nur auftreten,
weil Quarz eine geeignete Symmetrie dafür hat; dieser Effekt wird
dazu genutzt, Quarz als Taktgeber für Uhren und elektronische Geräte
einzusetzen.
Das Auftreten von „optischer Aktivität“ hingegen ist an das Fehlen
ganz bestimmter Symmetrieelemente geknüpft.
Der Zusammenhang zwischen Symmetrie und vielen chemischen und physikalischen Eigenschaften resultiert vor allem daraus, dass alle Wellenfunktionen eines Moleküls - gleichgültig, ob sie die Elektronenverteilung oder die Molekülschwingungen, NMR-Spektren u.s.w. beschreiben - streng mit bestimmten Erfordernissen übereinstimmen müssen, die auf die Symmetrie des Kerngerüstes des Moleküls zurückgehen.
Die enorme Bedeutung von Symmetriebetrachtungen als essentieller Bestandteil der heutigen Chemie, ist zudem darin begründet, dass die Symmetrie einer exakten mathematischen Behandlung zugänglich ist. Die Basis dazu ist ein Zweig der linearen Algebra, die Gruppentheorie. Im Gegensatz zur manchmal recht schwierigen Algebra, welche zur Ableitung wichtiger Sätze und Theoreme notwendig ist, sind die in der Gruppentheorie gebrauchten mathematischen Hilfsmittel relativ einfach, aber erstaunlich fruchtbar hinsichtlich der Ergebnisse. So haben beispielsweise Symmetrieüberlegungen und ihre gruppentheoretische Behandlung maßgeblichen Anteil an den Fortschritten der Quantenchemie und Spektroskopie und tragen in jüngster Zeit viel zum Verständnis des Verlaufs konzertierter Mehrzentrenreaktionen bei.
Eine gleichfalls sehr nützliche Anwendung des Konzepts der Molekülsymmetrie und der damit zusammenhängenden Nomenklatur liegt in der exakten Strukturbeschreibung. Ein Symbol wie etwa D4 h kann eine präzisere und eindeutigere Strukturinformation vermitteln, als dies mit vielen Worten möglich wäre. So erlaubt die Aussage, dass das [Ni (CN)4]2- -Ion D4 h -Symmetrie besitzt, die Schlußfolgerungen, dass es a) planar gebaut ist, b) alle Ni-CN-Gruppen linear sind, c) die C-Ni-C-Winkel alle 90° betragen und d) die vier CN-Gruppen sowie die vier Ni-C-Bindungen streng äquivalent sind.
Da sich der Gebrauch von Symmetriesymbolen in der chemischen Literatur immer mehr einbürgert, ist es unabdingbar, sich mit den Grundlagen der Symmetrie vertraut zu machen, einfach auch um viele Publikationen in der heutigen Chemie überhaupt verstehen zu können. Die nachfolgenden Seiten sollen deshalb dazu dienen, ausgehend von allgemeinen Betrachtungen zur Symmetrie, insbesondere den Begriff der Molekülsymmetrie und die sie beschreibenden Regeln näher zu bringen.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.