Ähnlich wie in zweiatomigen Molekülen kann man auch in mehratomigen Molekülen wichtige Informationen über die MO's aus Überlegungen zur Symmetrie des Moleküls sowie zur Symmetrie der an der Bindung beteiligten AO's erhalten. Näherungsweise sind unsere MO's Linearkombinationen aus AO's. Will man die Symmetrie des Problems ausnützen, so konstruiert man zuerst aus den AO's eine Sorte symmetrieadaptierter Linearkombinationen, sogenannte Symmetrie-AO's.
Wir wollen das zunächst an einem Beispiel, dem H2O-Molekül,
erläutern. Wir nehmen an, dass die Struktur gewinkelt ist, mit
zwei gleichen HO-Abständen (die Frage nach der Geometrie beantworten
die Walshschen Regeln). Die Symmetriegruppe des
Moleküls ist dann C2v. Die MO's des H2O müssen
dieser Symmetrie angepaßt sein (symmetrieadaptierte Orbitale), d.h.
sich wie irreduzible Darstellungen der Symmetriegruppe C2v transformieren.
Diese irreduziblen Darstellungen sind bei C2v alle eindimensional;
die Zahlen +1 oder −1 in der Charaktertafel
für C2v geben also an, ob ein MO symmetrisch oder antisymmetrisch
in Bezug auf die Symmetrieoperation der entsprechenden Spalte ist.
| C2v | E | C2 | σv(xz) | σv'(yz) |
| A1 | 1 | 1 | 1 | 1 |
| A2 | 1 | 1 | −1 | −1 |
| B1 | 1 | −1 | 1 | −1 |
| B2 | 1 | −1 | −1 | 1 |
Ein MO der Symmetrie a2 (wir verwenden Kleinbuchstaben für
die Einelektronenzustände, d.h. für die Orbitale, und Großbuchstaben
für den Gesamtelektronenzustand des Moleküls) ist also symmetrisch
bezgl. der Identitätsoperation (E) und bezgl. einer 2-zähligen
Drehung (C2) um die z-Achse (falls eine ausgezeichnete Achse
vorliegt, wird diese immer als z-Achse gewählt) und antisymmetrisch
bezgl. Spiegelung an der xz-Ebene und an der yz-Ebene. Das Kerngerüst
des Moleküls ist invariant gegenüber allen 4 Symmetrieoperationen.
Wir haben dabei noch die Freiheit, die beiden H-Atome in die xz- oder
die yz-Ebene zu legen. Nach der üblichen Konvention wird das Wassermolekül
so orientiert, das alle Atome in der yz-Ebene liegen und die z-Achse
(gleich Hauptdrehachse) die Winkelhalbierende des H-O-H-Winkels bildet.
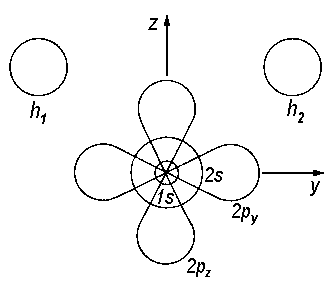 |
| Abb.1: AO's im H2O-Molekül. Das px-Orbital steht senkrecht auf der yz-Molekülebene. |
Es zeigt sich, dass das 1s-AO des O für sich allein in guter Näherung ein MO bildet. Wir wollen deshalb jetzt wie auch später die AO's der inneren Schalen weglassen und uns auf die Valenz-AO's beschränken. Dann können wir in 2s etc. die 2 weglassen und die AO's des Sauerstoffs als s, px, py, pz klassifizieren.
In Bezug auf C2v sind, wie man sich anhand der Charaktertafel klarmachen kann, die AO's des O bereits symmetrieadaptiert. Zur Übung wollen wir dies am Beispiel des px-AOs erörtern. Wir müssen jede der im Kopf der Charaktertafel angegebenen Symmetrieoperationen durchführen und sehen, ob sich bei dieser Operation das Vorzeichen der Wellenfunktion ändert.
Da bei der Identität E keine
Operation durchzuführen ist, bleibt das Vorzeichen der Wellenfunktion
erhalten und wir erhalten in der Spalte für E eine 1:
| E | C2 | σv | σ'v |
|---|---|---|---|
| 1 |
Als nächstes führen wir die Drehung
um 180° um die Hauptdrehachse (z-Achse) durch und sehen, dass
sich das Vorzeichen des px-Orbitals am Sauerstoff ändert.
Wir erhalten also für die Spalte C2 eine -1:
| E | C2 | sv | σ'v |
|---|---|---|---|
|
|
|
Nun führen wir die Spiegelung an der xz-Ebene
durch und erhalten, da sich das Vorzeichen der Atomorbitale nicht ändert
eine 1:
| E | C2 | sv(xz) | σ'v |
|---|---|---|---|
|
|
|
|
Bei der Spiegelung an der yz-Ebene ändert
sich das Vorzeichenmuster und wir erhalten somit eine -1:
| E | C2 | sv | sv'(yz) |
|---|---|---|---|
|
|
|
|
|
Vergleichen wir das Ergebnis unsereer Betrachtungen mit der obigen Charaktertafel für C2v, so erhalten wir für das px-Orbital des Sauerstoffatoms im Wasser das Mullikensymbol b1.
Auf diese Weise erhalten wir die einzelnen AO's zu den irreduziblen
Darstellungen von C2v
| AO | s | px | py | pz |
| irreduzible Darst. | a1 | b1 | b2 | a1 |
Im Gegensatz zu den AOs des Sauerstoffatoms, sind die AOs h1 und h2 nicht symmetrieadaptiert, weil C2 oder σ(xz) h1 in h2 überführt und umgekehrt. Man sieht aber sofort, dass die Linearkombinationen
hs = 1/Ö2
(h1 + h2)
(a1)
ha = 1/Ö2
(h1 − h2)
(b2)
symmetrieadaptiert sind, und zwar gehört, wie in Klammern angegeben, hs zu a1 und ha zu b2.
Aus den insgesamt 6 Symmetrie-AOs (s, px py, pz, hs, ha) lassen sich ebensoviele MO's bilden, wobei aber das Prinzip gilt, dass nur AOs der gleichen gleichen Symmetrie linearkombinieren (man sagt auch miteinander "mischen").
Da b1 nur einmal vorkommt, muss das einzige MO zur Darstellung b1 identisch mit dem AO zu dieser Darstellung, d.h. mit px, sein. Zu a1 gibt es drei MO's, die Linearkombinationen von s, pz, und hs sind, und zu b2 zwei MO's als Linearkombinationen von py und ha. Die Valenz-MO's sind also
1a1 = c11s + c12pz
+ c13hs
2a1 = c21s + c22pz
+ c23hs
3a1 = c31s + c32pz
+ c33hs
1b1 = px
1b2 = c44py + c45ha
2b2 = c54py + c55ha
Über die Koeffizienten cik wissen wir zwar zunächst
noch nichts. Offensichtlich ist aber z.B., dass in einem der beiden
b2-MO's die Koeffizienten gleiches Vorzeichen haben (nennen
wir dieses 1b2) und im anderen entgegengesetztes Vorzeichen
(nennen wir dieses 2b2), denn die MO's müssen zueinander
orthogonal sein. Diese MO's sehen schematisch so aus (schraffiert bedeutet
positive Werte der Wellenfunktion, nicht schraffiert negative), wie in Abbildung 2 dargestellt.
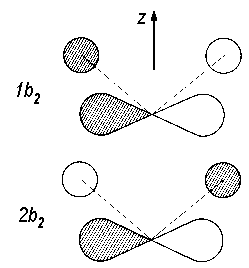 |
| Abb. 2: Schematische Darstellung des 1b2- und des 2b2-MO's in H2O. |
Das eine der beiden MO's (hier 1b2) ist also bindend, das andere (hier 2b2) dagegen antibindend. Allgemein gilt in ABn-Molekülen, dass dann, wenn zu einer irreduziblen Darstellung sowohl genau ein Symmetrie-AO von A als auch eines der n-Atome (d.h. von Bn) gehört, genau ein bindendes und ein antibindendes MO zu dieser Symmetrierasse existiert. Kommt eine Symmetrierasse entweder nur bei A oder nur bei Bn vor ( wie hier b1 bei O), so ist das MO ein AO von A oder ein Symmetrie-AO von Bn und in beiden Fällen zwischen A und Bn nichtbindend (nicht an der Bindung beteiligt).
Sind zu einer irreduziblen Darstellung (hier zu a1) mehrere Symmetrie-AO's von A oder von Bn vorhanden, so gilt grob, dass je ein Paar von AO's der beiden "Partner", A und Bn, eine bindende und eine antibindende Linearkombination bilden und dass verbleibende "überzählige" MO's nichtbindend sind.
Von unseren sechs MO's sind also zwei bindend, nämlich
Nach dieser Klassifikation der MO's besetzen wir jetzt die energetisch tiefsten MO's im Sinne des Aufbauprinzips. Im H2O sind 8 Valenzelektronen unterzubringen. Diese reichen gerade aus, um die beiden bindenden MO's (1a1 und 1b2) und die beiden nichtbindenden MO's (2a1 und 1b1) zu besetzen. Die antibindenden MO's bleiben unbesetzt. Hier das Ergebnis einer Rechnung.
Wir haben die MO-Konfiguration des H2O-Grundzustandes hergeleitet, ohne uns detaillierte Gedanken über die energetische Reihenfolge der MO's gemacht zu haben. Offenbar ist für diese Reihenfolge zweierlei wichtig:
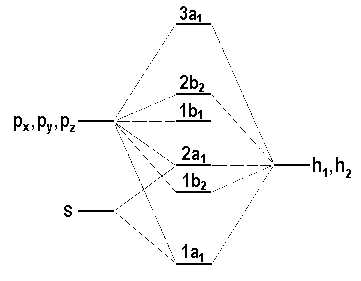 |
| Abb. 3: Qualitatives Schema der Valenz-MO-Energien im H2O. |
Hätten wir im H2O statt 8 Elektronen deren 12 unterzubringen, so müßten wir auch die antibindenden MO's besetzten. Dann wären gleichviel bindende wie antibindende MO's besetzt, und es gäbe bestimmt kein stabiles Molekül. In der Regel ist ein Molekül dann stabil (gebunden), wenn die Zahl der doppelt besetzten bindenden größer ist als die der doppelt besetzten antibindenden MO's. Die Differenz zwischen beiden Zahlen entspricht der Anzahl der Bindungen.
Bei Überlegungen der Art, wie wir sie soeben anstellten, ist noch zu bedenken, wie weit die beteiligten Atome kovalente Bindungen eingehen und ein Molekül, nicht aber Ionen entstehen. Läge z.B. das AO h1 bzw. h2 energetisch sehr hoch über s und p, so würden die bindenden MO's 1a1 und 1b2 praktisch von der Form
1a1 ≈ c11s + c12pz
1b2 ≈ py
sein, sie wären also nichtbindend und am O-Atom lokalisiert. Besetzten wir jetzt 1a1, 1b2, 2a1 und 1b1, so erhalten wir ein O2−, und die beiden H-Atome haben ihre Elektronen verloren. Beliebig viele Elektronen lassen sich wegen der Elektronenabstoßung nicht übertragen, in einem MO-Schema der verwendeten Art merkt man das aber nicht. In Fällen starker Ladungsübertragung von A nach Bn oder umgekehrt kann man sich durch eine naive Betrachtung der MO-Diagramme leicht irreführen lassen.
Im Grunde genügt zum Verstehen der MO-Konfiguration des H2O
und anderer Moleküle mit C2v-Symmetrie folgende Tabelle,
wie sie zuerst von Kimball (G.E. Kimball, J.Chem.Phys. 8, 188 (1940)) aufgestellt
wurde.
| Kimball-Tabelle für AB2-Moleküle mit C2v-Symmetrie | |||||
| Atom | C2v | a1 | a2 | b1 | b2 |
| A | s
p d |
1
1 2 |
0
0 1 |
0
1 1 |
0
1 1 |
| B2 | σ
π |
1
1 |
0
1 |
0
1 |
1
1 |
| (dabei liegen die B-Atome in der yz-Ebene) | |||||
In dieser Tabelle ist beim Atom A angegeben, in welche irreduziblen Darstellungen (Symmetrierassen) bezgl. C2v die AO's von A übergehen bzw. aufspalten: aus dem s wird ein a1-Orbital, aus den 3 p's wird ein a1, b1, bzw. ein b2-Orbital, aus den 5 d's werden zwei a1-Orbitale, bzw. ein a2, b1, bzw. b2-Orbital. Bei Bn findet man, zu welchen irreduziblen Darstellungen die Symmetrie-AO's gehören, die man aus σ-AO's bzw. π-AO's der B-Atome konstruieren kann. Die Bezeichnungen σ und π beziehen sich dabei auf die jeweilige AB-Verbindungslinie. AO's, die rotationssymmetrisch um diese AB-Achse sind, gelten als σ-AO's, solche, die eine Knotenebene in dieser Achse haben, heißen π-AO's. Beispielsweise führt die positive Linearkombination für σ (s-Elektronen: s1+s2 = a1) zum a1-Orbital und die negative Linearkombination zum b2-Orbital. Die positive (negative) Linearkombination der beiden p-Elektronen, die in der yz-Ebene liegen, führt zum a1-Orbital (b2-Orbital). Die positive (negative) Linearkombination der beiden p-Elektronen, die senkrecht zur yz-Ebene stehen, führt zum b1-Orbital (a2-Orbital).
Die Anwendung der Kimball-Tabelle auf das H2O besteht jetzt darin, dass man sich auf s, p und σ beschränkt und feststellt, dass zu a1 zwei AO's von A und ein AO von B2 gehören (also die MO's 1a1 [bindend], 2a1 [nichtbindend], 3a1 [antibindend]), zu a2 kein AO (also kein MO), zu b1 ein AO von A (1b1 [nichtbindend]), zu b2 je ein AO von A und B2 (folglich 1b2 [bindend], 2b2 [antibindend]).
Vielfach kennzeichnet man antibindende MO's auch mit einem Stern, z.B. b2* statt 2b2.
![]()
Auf diesem Webangebot gilt die Datenschutzerklärung der TU Braunschweig mit Ausnahme der Abschnitte VI, VII und VIII.